斩获诺奖,再掀热潮 基因编辑到底是什么?

北京时间10月7日,瑞典皇家科学院在斯德哥尔摩宣布,将2020年度诺贝尔化学奖授予科学家伊曼纽尔·夏彭蒂埃(Emmanuelle Charpentier)和珍妮弗·A·杜德娜(Jennifer A. Doudna),奖励她们在基因组编辑方法上的突破。
诺贝尔奖委员会在官方新闻稿中称:“自2012年夏彭蒂埃和杜德娜发现CRISPR/Cas9基因“魔剪”以来,它们的使用量激增......将生命科学带入了一个新时代,并在许多方面为人类带来了最大利益。”
基因编辑(Genome Editing),又称基因组工程,是遗传工程的一种,是指在活体基因组中进行DNA插入、删除、修改或替换的一项技术。其与早期的遗传工程技术的不同之处在于,早期的遗传工程技术是在宿主的基因、基因组中进行随机插入基因物质,而基因编辑是在特定位置插入基因片段。
为什么要进行基因编辑
基因可被视作基本遗传单位,支持着生命的基本构造和性能。储存着生命的种族、血型、孕育、生长、凋亡等过程的全部信息。生物体的生、长、衰、病、老、死等一切生命现象都与基因有关。它也是决定生命健康的内在因素。因此,基因具有双重属性:物质性(存在方式)和信息性(根本属性)。
可以说,基因决定性状表现,双眼皮,大眼睛都是由基因决定的(整容除外)。除了外在的特征表现,基因更大的决定性作用体现在内部。由于基因的数量众多,携带的信息也是海量,在复制过程中可能或出现错误,造成基因缺陷,这种缺陷还具有遗传性。
1987年诺贝尔诺贝尔生理学或医学奖得主利根川进曾表示,除了外伤,一切疾病都与基因有关。遗传基因缺陷也是引发疾病的三大根本原因之一。
例如,美国演员安吉丽娜·朱莉家族遗传了突变的BRCA1基因。BRCA1本是具有抑制恶性肿瘤发生作用的基因,其通过编码产生肿瘤抑制蛋白。如果发生突变,其蛋白产物不进行或不能正常行使功能,DNA损伤可能得不到适当的修复,从而使细胞可能形成其他遗传信息的改变,导致癌症。
正是由于这一基因作祟,朱莉家族中的女性多患乳腺癌和卵巢癌,根据基因检测,她本人患乳腺癌和卵巢癌的几率也高达87%和50%。为了防范患癌风险,她最终选择切除双侧乳腺。
除了癌症外,常见的遗传性疾病还有地中海贫血、先天性肌强直、血友病、白化病、视网膜母细胞瘤以及家族性结肠息肉病等。
遗传疾病由于有基因造成,所以几乎不可能治愈,患者需要终身用药以缓解病症,不止承受巨大的身体和心理压力,经济压力也同样令人难以承受。
有没有一劳永逸的办法呢?
基因编辑,人类走出了三条路
用药讲究对症下药,遗传疾病的根源就在于基因缺陷,因此,要一劳永逸的解决遗传疾病,可以利用基因编辑。
人类目前已经开发出了三种编辑手段,分别是锌指核酸酶(Zinc Finger Nucleases, ZFN),转录激活样效应因子核酸酶(Transcription Activator-like Effect Nucleases,TALEN)和成簇规律间隔短回文重复(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPR/Cas9)系统。
要进行基因编辑,首先就需要将产生变异的基因“切割”,在基因这样微观的级别上进行切除,对工具的要求就很高。
“切割”的实质就是在基因组内特定位点创建DNA双链断裂(Double-Strand Breakage,DSB),也就是在DNA双螺旋结构中两条主链的同一对应处或紧密相邻处同时断裂。

DNA双螺旋结构示意图
在研究中,人们发现核酸酶在“切割”方面表现不错。那么这种酶是如何实现切割的呢?
从上图我们可以看出,DNA双螺旋结构包含两个部分,即两个长链和与其垂直的数个“短杠”。其中,两个长链被称为主链(backbone),“短杠”实则为碱基对(basepair,bp)。主链直径2nm,主链间距3.4nm,一个螺旋周期包含10对碱基,相邻碱基间距0.34nm。
切割是在主链上进行的,两个切割点应当处于相对应的位置。主链由脱氧核糖和磷酸基通过酯键交替连接而成,而核酸酶刚好可以将这种键结切断,进而在两条主链上各产生一个切口,且不破坏碱基对。
由于切割需要在特定的基因片段上进行,因此首先就需要识别出特定片段。遗憾的是,核酸酶通常在多个位点进行识别和切割,特异性较差。
为了解决识别问题,科学家对一些核酸酶进行了改造,这就包括上面提到的ZFN,TALEN和CRISPR/Cas9。
第一代基因编辑手段采用的就是ZFNs,这种酶由两个功能结构域组成:DNA结合结构域和DNA切割结构域。
一个DNA结合结构域包含一个双指模块链,每个模块识别一个独特的六聚体(即6个碱基对)DNA序列。这一结构域就充当定位器的作用,用于识别特定片段。当其与DNA切割结构域融合在一起时,就形成了具有高度特异性的“基因组剪刀”。
主链断裂后,细胞自带的两种修复机制同源重组修复(HDR)和非同源末端连接修复机制(NHEJ)被激活,基因开始自我修复。
ZFNs虽然相对于常规核酸酶特异性有所提高,但还是不够。易产生非特异切割,即脱靶切割。脱靶可能导致过度双链断裂,使修复机制不堪重负,还有可能导致DNA随即整合,产生难以预料的后果。
第二代基因编辑技术采用TALENs。这种酶也由两个部分组成:激活因子样效应物(transcription activator-like effector)和DNA切割结构域。前者是一种由植物细菌分泌的天然蛋白,具有识别特异性DNA碱基对的特性。将其与DNA切割结构域结合后,二者相互作用,就成了基因编辑的“剪刀”。
与上一代相比,其特异性更高,因此脱靶的概率更低,所带来的后果也就越小。不过,其生产过程较为繁琐,过程需要用到液体操作机器人(liquid-handling robot)。
第三代使用的是CRISPR/Cas9技术,近些年的关注度非常高。今年的诺贝尔奖颁给这一领域的科学家也说明了科学界对其的认可。
CRISPR/Cas系统本身并不是为了基因编辑而生,它是一种存在于多数细菌与绝大多数的古菌中的一种后天免疫系统。
1987年,日本科学家在大肠杆菌的基因体发现一段古怪的规律序列,某一小段 DNA居然一直重复出现,而重复片段又被相同的间隔隔开,用途不明。后来,人们又在其他细菌中也发现了这一特征。
CRISPR为人所熟知得益于西班牙微生物学家弗朗西斯科·莫伊卡(Francisco Mojica)的一篇论文,他在论文中指出,这是一种广泛存在的免疫机制,用于防范病毒入侵。
病毒入侵时,会将自身的DNA注入到细胞当中,以便进行繁殖(癌细胞通常就采取这种做法)。不过,检测到病毒入侵后,免疫系统激活,开始识别和杀死病毒。病毒清除完成后,有的细胞会将病毒的DNA碎片以间隔(下图右部彩色部分)的形式注入到自己的基因中。

CRISPR位点完整结构图(图源:http://blog.sciencenet.cn/blog-3160644-983657.html)
总的来说,这一系统相当于一个“黑名单”,对所有入侵的病毒进行DNA建档,在其下次入侵时可以快速识别并杀死。
上图中的前导区(leader)被认为是CRISPR序列的启动器。左侧基因编码的蛋白均可与CRISPR序列区域共同发生作用,如Cas1 和Cas2就是用于扫描并切割病毒的DNA片段。
目前已发现了三种不同类型的 CRISPR/Cas系统,存在于大约40%和90%已定序的细菌和古菌中。CRISPR/Cas9系统就属于第二种,是目前最成熟也是应用最广的类型。
用于基因编辑的CRISPR/Cas系统由Cas9核酸酶与向导RNA(small guide RNA)构成。后者指导Cas9识别特定基因靶位,切割DNA造成双链DNA断裂,并启动DNA损伤修复机制。
具体流程如下图:
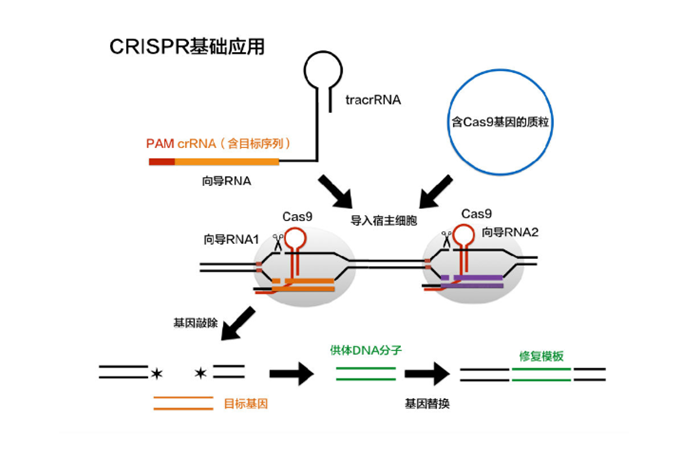
CRISPR/Cas9基因编辑示意图 (图源:http://blog.sciencenet.cn/blog-3160644-983657.html)
使用该技术进行基因编辑时,在基因的上下游各设计一条向导RNA(向导RNA1,向导RNA2),将其与含有Cas9蛋白编码基因的质粒一同转入细胞中。向导RNA通过碱基互补配对可以定位特定基因靶位,Cas9蛋白会使该基因上下游的DNA双链断裂(原理和上述ZFN一致)。
DNA双链断裂后,生物体自身存在着的DNA损伤修复机制开始工作,会将断裂上下游两端的序列连接起来,从而实现了细胞中目标基因的敲除。
当然,要实现基因替换,需要在上述基础上为细胞引入供体DNA分子,这样细胞就会按照提供的模板在修复过程中引入片段插入或定点突变。这样就可以实现基因的替换或者突变。
相对于前两代技术,CRISPR/Cas9基因编辑技术操作简单,成本低廉,但它还是没有彻底解决脱靶问题。
应用方面,除了基因敲除,基因替换等基础编辑方式,还可以被用于基因激活,疾病模型构建,甚至是基因治疗。
目前,科学家在实验室已完成了对斑马鱼、老鼠和人类细胞的编辑。2017年,美国国家眼科研究所研究人员吴志健(音译)及同事利用这一技术成功阻止了实验鼠视网膜退化并改善了视觉。该研究证明了利用该技术治疗疾病的可行性。
不过,这一技术目前还无法运用到人体,这其中既有技术因素,也有伦理问题。例如,此前川大华西医院的研究团队利用CRISPR-Cas9基因编辑技术治疗肺癌的临床试验就需要通过医院审查委员会的伦理审批。2018年原南方科技大学副教授贺建奎的“基因编辑婴儿”实验掀起轩然大波,主导人最终还身陷囹圄。
当然,基因编辑技术的巨大应用前景着实令人憧憬,此次诺贝尔奖也表明这一技术的重大意义,至于其涉及的伦理问题,可以通过监管加以规范。











